Dans cet article, je vais vous expliquer le sujet de mon mémoire, c’est-à-dire mon investigation pour déterminer si la mutation MDR1 influence le comportement chez le chien… et je vais en profiter pour ajouter un aspect “Philosophie des sciences”. Comme on va le voir, il y a plein de pistes, dans la recherche académique, qui ont été commencées, et puis sont finalement tombées en friche, sans raison apparentes. On va essayer de comprendre ce qui a pu se passer…
Des colleys décèdent pour des raisons mystérieuses…
Dans les années 80, des cas commencent à apparaitre, chez certains vétérinaires, de Colleys souffrant soudain de troubles neurologiques graves, menant même à la mort dans certains cas. Le point commun est souvent l’Ivermectine, un vermifuge régulièrement utilisé chez les chevaux et chez les chiens… mais pourquoi des affections neurologiques ? Et pourquoi seulement chez certains chiens, et de manière aussi grave, sans gradation ?

Des études montreront plus tard que l’Ivermectine, utilisée à des doses normales pour un usage comme vermifuge, ne devraient pas causer une telle réaction même chez ces chiens particuliers. Mais, fait peu connu, l’Ivermectine est aussi utilisée à l’époque en off label pour des affections cutanées… et là elle est utillisée à des doses largement supérieures à l’usage comme vermifuge. Les cas reportés ne mentionnent pas forcément la raison pour laquelle les chiens concernés ont reçu de l’Ivermectine, ni à quelle dose, puisqu’au moment où le vétérinaire est consulté, les troubles neurologiques sont là, et il est trop tard pour doser ce qui a été donné. Cette hypothèse expliquerait néanmoins la violence des symptômes, qui n’est pas forcément compatible avec les doses recommandées d’Ivermectine comme vermifuge, même chez ces chiens. On ne connait pas encore le mécanisme d’action à ce stade, mais il faut savoir que les symptômes neurologiques commencent à apparaitre à de petits multiplicateurs de la dose recommandées (3x, 4x la dose recommandée chez ces Colleys, alors que la dose létale chez les autres chiens est plus de 200x plus élevée): la marge thérapeutique est assez réduite, en particulier pour une espèce dont le poids peut énormément varier d’un individu à l’autre… En attendant que la recherche avance, le message est clair: ne pas utiliser l’Ivermectine chez les Colleys.
L’arrivée de Katrina Mealey, et la découverte du lien avec le gène MDR1

Un peu avant 2001 (date de sa publication Mealey et al., 2001 ), Katrina Mealey, vétérinaire et chercheuse à la Washington State University, a une de ces intuitions qui permettent à la recherche de faire des bonds…
Depuis les années 1970, la médecine est confrontée à un problème d’efficacité de certains médicaments anticancer: les médicaments ne parviennent pas à pénétrer suffisamment dans les organes visés. Le coupable est connu depuis au moins 1976 Schinkel et al., 1994 : il s’agit d’une protéine, la P-glycoprotéine, aussi appelée MDR1, qui protège certains organes (dont le cerveau) en évacuant des molécules spécifiques vers la circulation, les empêchant de pénétrer en quantité dans les organes concernés. Alfred Schinkel et son équipe au Netherlands Cancer Institute ont développé une lignée spécifique de souris ne disposant pas du gène permettant de produire cette protéine, à des fins de recherche. Et il s’avère que ces souris sont particulièrement sensibles… à l’Ivermectine.
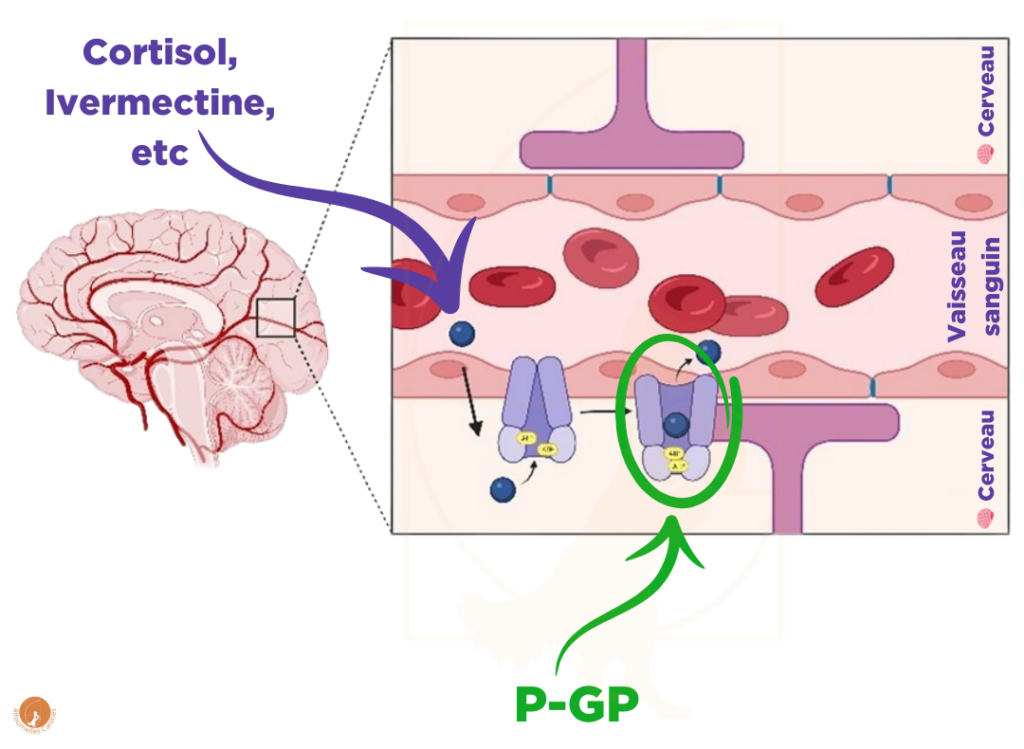
Katrina Mealey fait donc le lien, et teste cette hypothèse : elle mesure les taux d’Ivermectine dans le sang et dans le cerveau des Colleys décédés et des Beagles de laboratoire, séquence le gène MDR1 de ces chiens, et “Eurêka” ! Le lien est là ! Une mutation du gène MDR1 chez le chien serait donc responsable de cette hypersensibilité médicamenteuse qui cause des désordres neurologiques pouvant mener au décès.
A partir de là, la recherche peut tourner: on connait la cause de ce problème de médecine vétérinaire, et on a un modèle scientifique validé pour l’explorer. On peut tester tous les médicaments susceptibles d’être transportés par la P-gp grâce à des souris de laboratoire, et adapter les traitements pour les chiens. On peut aussi séquencer le gène MDR1 chez les chiens individuels susceptibles de porter la mutation, et on peut aussi mener des études sur les populations pour voir dans quelles races il est présent. Dans un sens, le problème est résolu : on est sur des rails…
Le lien entre P-gp et Cortisol
Mais à côté de ça, chez les humains, la recherche continue. Non seulement la P-gp reste un sujet de recherche important pour les traitements anticancer, mais il est également connu depuis pratiquement les débuts de la découverte de la P-gp que les stéroïdes, dont le Cortisol, font partie des molécules transportées par la P-gp…
Vous vous souvenez de l’article sur le Cortisol ? Au niveau de la barrière hémato-encéphalique se trouve la P-gp, qui raccompagne à la sortie une grande partie du Cortisol qui tente de pénétrer dans le cerveau. L’Hypothalamus jauge donc les besoins du corps en Cortisol sur un taux “filtré”, diminué par l’action de la P-gp.
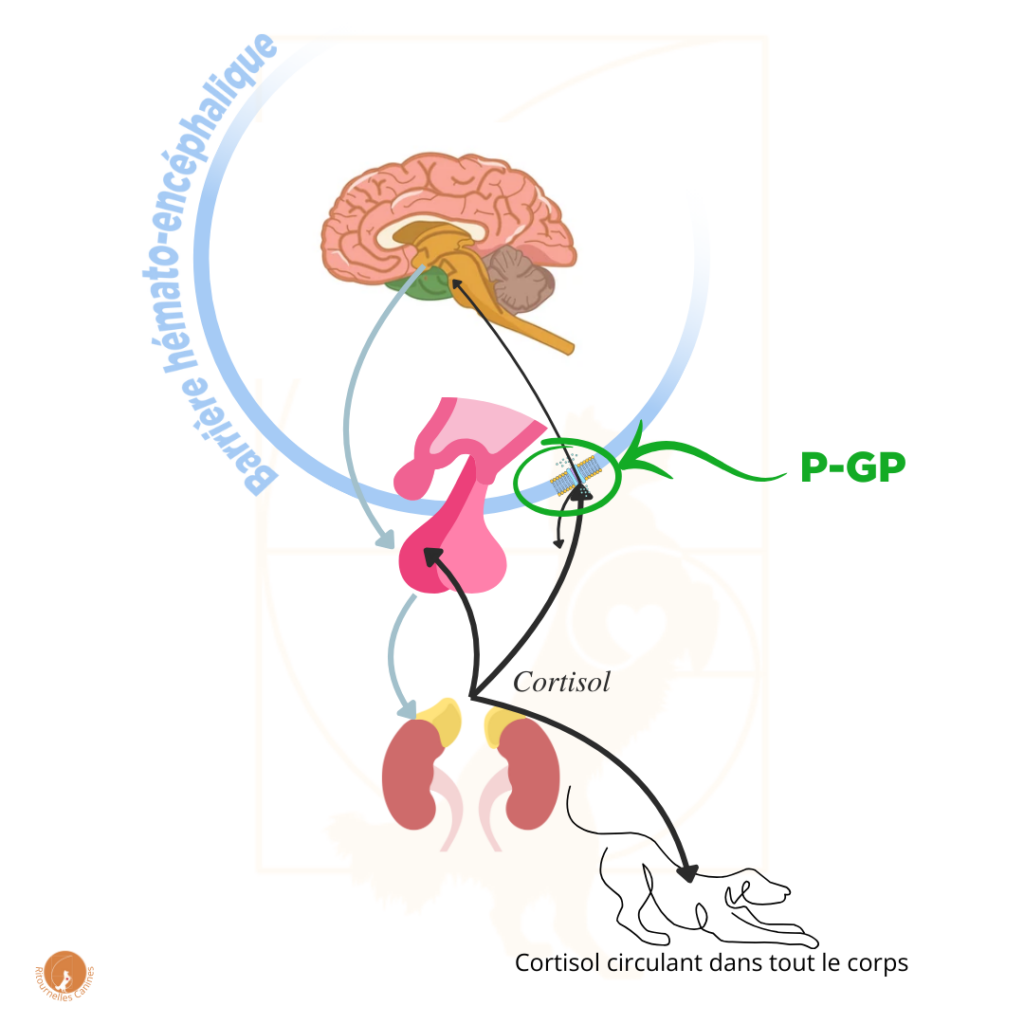
Or, chez les humains, une série de problématiques psychologiques sont liés au fonctionnement de l’axe du stress. Au-delà de la problématique vétérinaire canine, il y a donc encore des recherches qui se poursuivent sur la P-gp, et également sur son rôle au niveau de l’axe du stress.
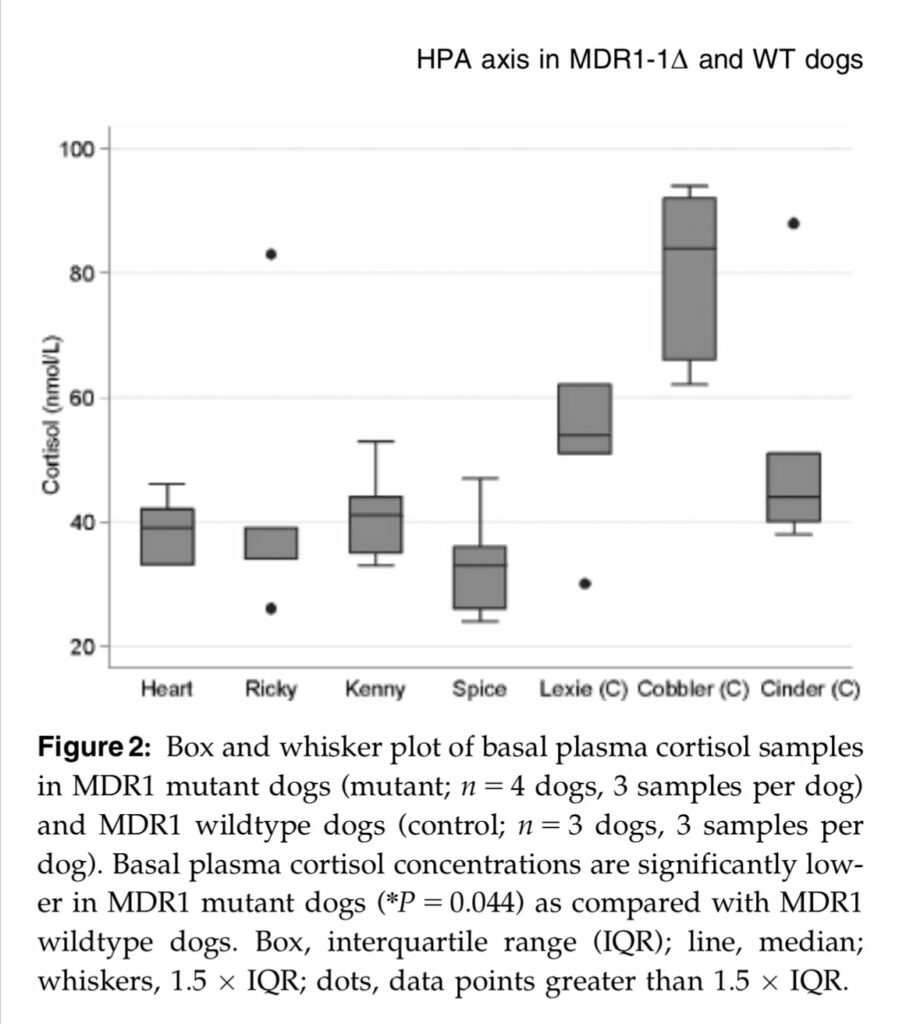
Une série de recherches sur les souris (et une chez les chiens… par Katrina Mealey et son équipe en 2007) montre notamment que les animaux dont la P-gp n’est pas fonctionnelle ont un profil particulier au niveau de l’axe du stress : vu que la P-gp ne fait pas son boulot de barrière, l’Hypothalamus reçoit plus de Cortisol que prévu. Or l’Hypothalamus ne sait pas qu’il y a un problème avec la P-gp et qu’elle doit adapter ses normes, évidemment. Donc elle envoie le signal de stopper la production de Cortisol alors que ce dernier n’est pas encore en niveaux suffisant pour le reste du corps. Résultat, on obtient un taux de Cortisol basal plus bas, et un pic de Cortisol lié au stress interrompu avant que tout le cycle du stress ait pu être complété (et accessoirement, les GR, eux, s’adaptent à ces taux bas en augmentant leur densité, ce qui rend les cellules encore plus sensibles aux moindres variations de Cortisol).
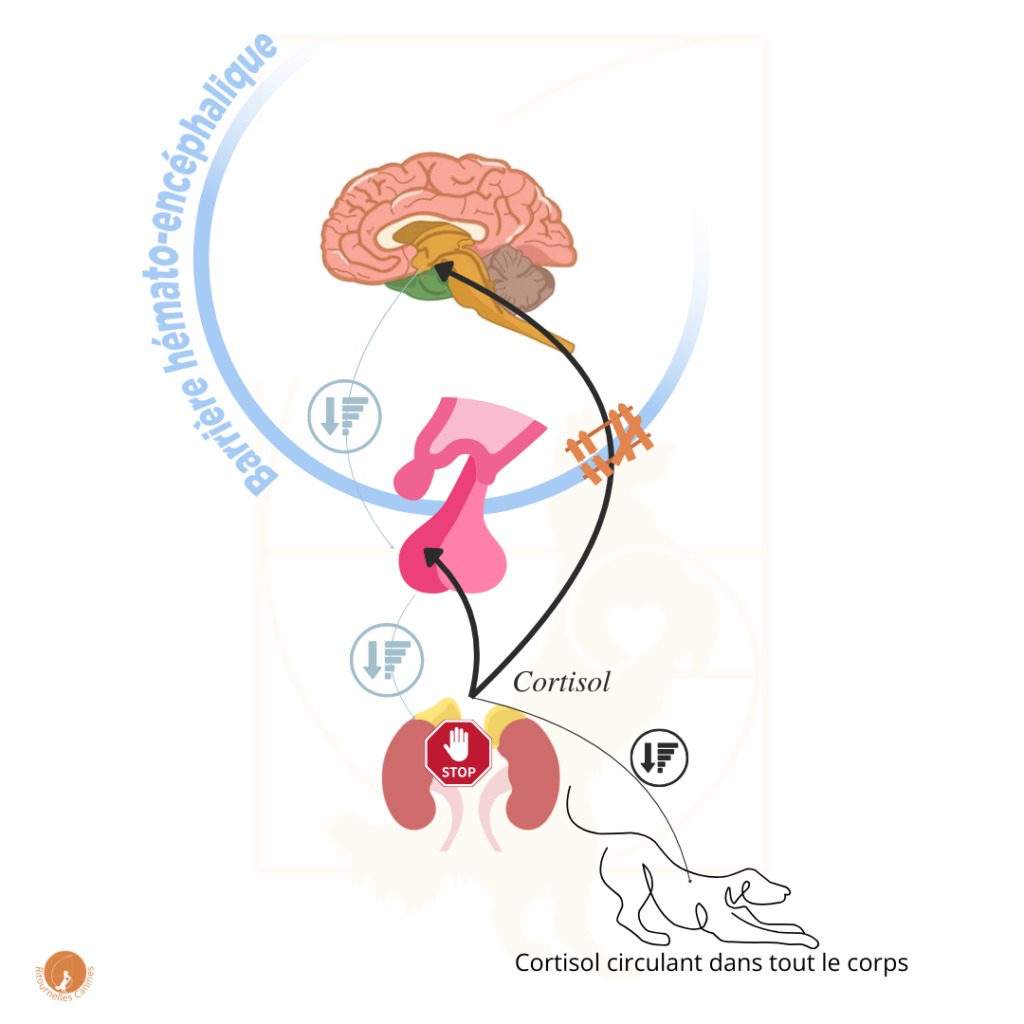
Curieusement, ce profil de fonctionnement de l’axe HPA, typique de la mutation MDR1, se retrouve également dans un autre profil psychologique, comme le montrent les travaux de Rachel Yehuda et son équipe : le stress post-traumatique (PTSD).
On retrouve donc, dans la recherche visant les humains, pas mal de développements concernant des profils de fonctionnement de l’axe HPA différents du fonctionnement normal, et qui sont corrélés à différentes problématiques psychologiques.
Pourtant, les recherches concernant le lien entre mutation MDR1 et Stress ne prennent pas… Pourquoi ?
En réalité, suite à ces découvertes du lien entre P-Gp, mutation, et problématiques comportementales notamment chez les souris, des recherches sont faites en termes de séquençage afin de voir si une telle mutation pourrait être corrélée à des problématiques psychologiques chez les humains. Or ces recherches ne donnent rien. Le sujet est donc plus ou moins abandonné, car il n’a pas d’intérêt pour le traitement des humains.
Et chez les chiens ?
Comme on l’a vu, le domaine principal de recherche visant la mutation MDR1 chez les chiens concerne le risque le plus important, car létal, c’est-à-dire la pharmacologie. Maintenant que cet aspect-là est plus ou moins réglé, il n’y a plus trop de raisons d’étendre le champ de recherche…
Du côté des pathologies liées au Cortisol, si on prend les symptômes cliniques vétérinaires (donc pas les symptômes comportementaux / psychologiques), la mutation n’a pas un impact suffisamment important par rapport aux pathologies bien connues comme la maladie d’Addison ou celle de Cushing. De plus, ces pathologies sont facilement identifiables sans devoir passer par la génétique : on voit s’il y a trop ou pas assez de Cortisol, ou voit si c’est lié à un problème de surrénales ou d’une tumeur hypophysaire, et on rééquilibre. La mutation altère l’axe HPA dans une limite qui n’est pas assez extrême pour faire apparaitre des symptômes physiologiques flagrants.
_Brussels%2C_BE.jpg)
Mais depuis une vingtaine d’années, la cognition canine devient un important domaine de recherche, lié notamment à un changement de perspective en termes de valeur dans notre rapport à l’animal. Pour caricaturer, avant, le chien était vu comme un animal bâtard, indigne de l’intérêt des éthologues car pas assez “naturel”, trop domestiqué, et pas très intéressant non plus pour les sciences cognitives car il n’apportait pas grand chose, coincé entre les humains (le top, mais on ne peut pas faire d’expériences invasives dessus), les grands singes (”proches” de l’humain sans être l’humain, donc prometteurs) et les rongeurs (sur lesquels on peut faire les expériences qu’on veut). Aujourd’hui, le chien est vu comme justement rendu particulièrement intéressant par son statut d’animal “bâtard”, au croisement entre la “nature” et la “civilisation” humaine: un animal qui vit dans le même monde urbanisé que nous, dans nos maisons, mais qui en même temps n’est pas l’humain.
Bref, il y avait donc là un vide, parce que la recherche sur le MDR1 était passée à autre chose, malgré que le chemin était déjà en grande partie pavé. Et pourtant, dans le même temps, on commence à s’intéresser de plus en plus à l’influence des pathologies de l’axe du stress sur le comportement canin, comme en témoignent les recherches de l’équipe de Daniel Mills…
Mon sujet de recherche
Récapitulons. Actuellement, avec ce qu’on a vu, au niveau de la recherche, on en est là:
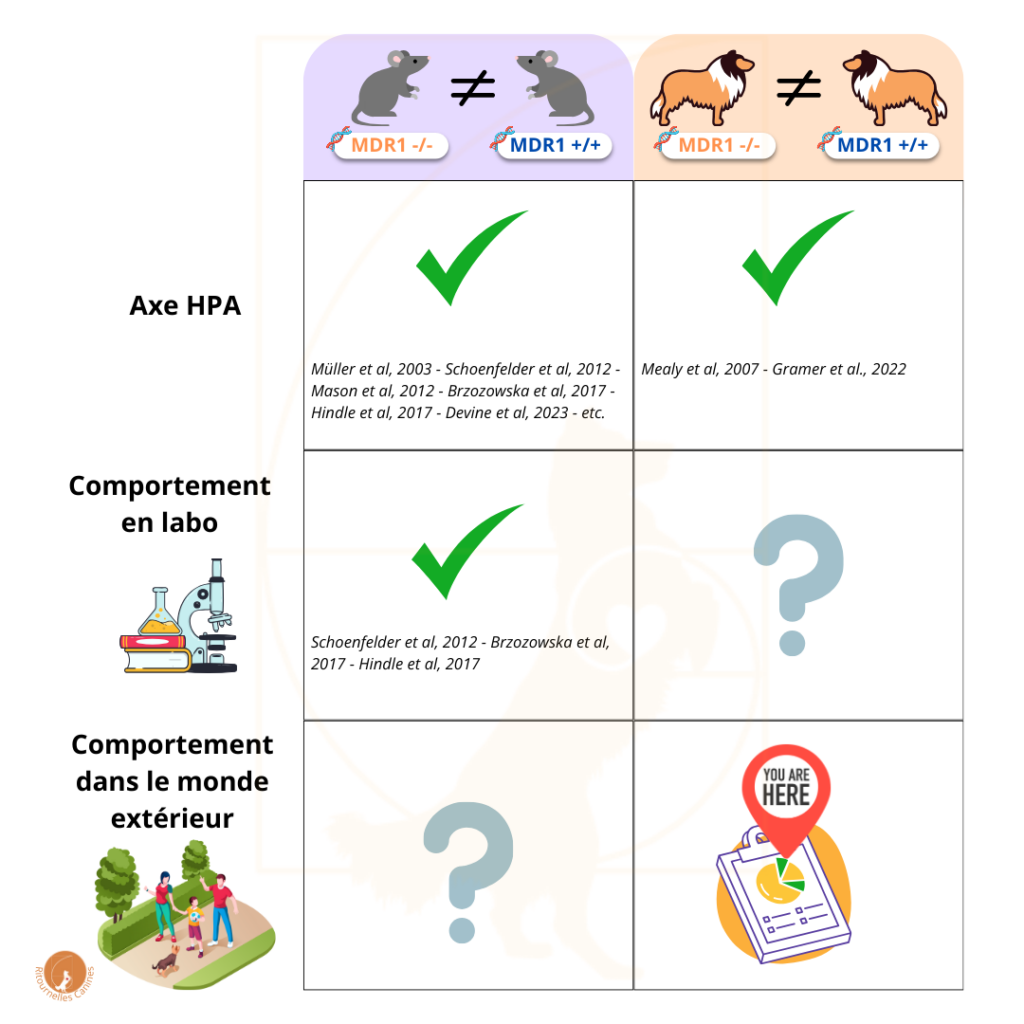
Le lien entre la mutation MDR1 et l’axe HPA a été démontré chez les souris et chez les chiens, et l’impact sur le comportement a été démontré chez des souris de laboratoire. Il reste encore à déterminer si l’impact sur le comportement canin se vérifie…
En théorie, pour faire une étude objective, il faudrait pouvoir mesurer tout ça en laboratoire. Malheureusement, d’une part je n’avais pas accès à ce type d’infrastructure (et de financement), mais d’autre part, il y a aussi une raison plus fondamentale qui rendait cette méthode inadéquate : pour pouvoir tester le comportement de chiens en laboratoire, encore faut-il que ces chiens parviennent à se comporter normalement dans le cadre de cette infrastructure, pour que le test puisse avoir lieu dans des bonnes conditions. Or, dans ce cas-ci, vu que l’hypothèse est justement que, si cela a un impact, cet impact porte justement sur leur résilience et leur capacité à gérer le stress et la nouveauté… ces chiens ne se comporteraient probablement pas normalement dans le contexte d’un laboratoire !
Je devais donc recourir à l’autre design de recherche couramment utilisé en comportement canin, à savoir une recherche par questionnaire. Evidemment, cela amène d’emblé des limitations:
- Il peut y avoir des divergences d’interprétation d’une personne à l’autre (par exemple, prenons une question demandant si le chien aboie souvent, de 1 à 5. Pour une personne, si son chien aboie une fois par jour, c’est “souvent”, et il mettra 4, alors que pour une autre personne, “souvent” c’est toutes les heures, donc cette personne mettra 1 si son chien aboie une fois par jour).
- On ne touchera que des personnes déjà engagées sur le sujet. Par exemple, sur un groupe lié à la réactivité canine, on aura plus de gens dont les chiens sont réactifs que dans la population générale, et probablement des gens qui sont en démarche de recherche de solution
- Ce sont des chiens qui vivent dans le monde extérieur, donc il y a une variabilité et de multiples facteurs non contrôlés qui interviennent. Ce sont forcément tous des chiens qui ont des vécus différents dont on ne connait rien, qui vivent dans des situations toutes différentes, avec des gardien·ne·s qui n’ont pas tou·te·s le même rapport au chien ni même les mêmes compétences de lecture de leur chien.
Au final, même en ayant bien construit le questionnaire, il est fort probable que la différence que fait la mutation soit noyée dans toute la variabilité des autres facteurs. Peut-être qu’il y a une différence, mais qu’elle passera sous les radars de mon étude… C’est un risque à prendre.
La méthode
J’ai commencé par relever dans la littérature académique tous les comportements qui avaient été relevés comme étant corrélés à des différences de taux de cortisol ou de fonctionnement de l’axe HPA. Vu qu’il y a assez peu d’études là-dessus chez les chiens, j’ai également regardé ce que la recherche indiquait pour les rongeurs et pour les humains, pour voir si on pouvait prudemment faire des transpositions… mais pas seulement.
En analysant tout cela, j’ai tenté d’identifier:
- d’une part, des différences spécifiques à ce profil de fonctionnement de l’axe HPA (bas cortisol basal, boucle de feedback négatif accrue, plus grande densité de GR), donc pas les comportements qui apparaissent dans d’autres profils.
- d’autre part, des différences non-spécifiques à un profil, mais qui témoignent quand même d’une altération de l’axe HPA. Par exemple, une instabilité d’humeur ou de l’anxiété peuvent apparaitre dans plusieurs profils différents voire contradictoires (cortisol trop bas mais aussi cortisol trop haut) : ils sont donc symptômatiques d’une altération de l’axe HPA de manière générale.
A partir de là, j’ai pu construire un formulaire qui portait sur des comportements susceptibles d’être différents entre un chien avec un axe HPA normal, et un chien qui porterait la mutation.
Au final je suis arrivé aux questions suivantes:
(insérer les questions)
Evidemment, rien n’était souligné en gras dans le questionnaire soumis, j’ai ajouté cela ici pour la facilité de lecture… De même, je n’encourage certainement pas de réprimander son chien, mais cette question était pertinente dans ce cadre, parce qu’il y a des gardien·ne·s qui le font, et la réaction du chien peut être symptômatique (cette question vient d’un questionnaire de l’équipe de Daniel Mills). Ceux et celles d’entre vous qui sont familier·e·s avec des chiens sensibles, anxieux, réactifs, reconnaitront pas mal de traits: ils ne sont pas forcément spécifiques à la mutation, mais ils sont pertinents pour comparer les chiens qui possèdent la mutation par rapport à ceux qui ne la possèdent pas: si ceux qui ont la mutation scorent statistiquement plus haut, en moyenne, sur certaines questions, que les chiens sans mutation, il est fort probable que ce soit lié à la mutation, sinon les moyennes ne seraient pas différentes.
J’ai ensuite soumis le questionnaire à un maximum de groupes Facebook centrés sur les Colleys, pour limiter au moins le facteur race, et j’ai analysé les résultats au moyen de méthodes statistiques. D’ailleurs, c’est assez intéressant de noter que même dans ce domaine (et c’est logique puisque c’est un domaine scientifique), il existe des débats et donc des positions différentes sur les méthodes les plus adaptées à utiliser dans tel ou tel cas… C’est loin d’être aussi clair qu’il n’y parait !
Résultats
Au final, j’ai obtenu 140 réponses, dont 108 Colleys dont le statut MDR1 était connu par leur gardien·ne·s. J’ai procédé à différentes analyses (le fameux χ2), de la plus large à la plus précise (le tau-c de Kendall), pour voir ce qui ressortait. Il existe une accusation, dans le monde de l’analyse statistique, qui est celle de faire du “p-hacking”, c’est-à-dire d’appliquer plein de tests différents un peu comme on va à la pêche, en espérant tomber à force sur un résultat significatif. On est donc tenus de prouver que ce n’est pas ce que l’on fait, de montrer patte blanche, de différentes façons. Or, il y a aussi, comme dans tous les domaines académiques, une obligation implicite : celle d’utiliser des méthodes acceptées par les collègues, peu importe qu’elles soient les plus adaptées ou non. Par exemple, dans les études de comportement canin, il est plus facile d’utiliser le C-BARQ, qui est le test de comportement le plus reconnu, que d’aller créer un nouveau questionnaire. On va parfois donc utiliser une méthode qu’on trouve problématique (par exemple, le C-BARQ associe certains comportements à la peur, et d’autres à l’agression, qui deviennent deux traits exclusifs : c’est soit l’un, soit l’autre. Et un chien qui aboie est donc agressif, et pas peureux), parce que ça évitera des problèmes avec les collègues… ou dans le cas des publications peer-review, avec les reviewers. Il n’est pas rare en effet que les reviewers critiquent une étude parce que l’auteur n’a pas utilisé la méthode classique, et qu’ils ne veulent pas chercher plus loin, il faut utiliser la méthode classique. Vu l’investissement en temps et en argent que demandent les publications, cela encourage à utiliser les méthodes qui auront le plus de chances de plaire aux reviewers plutôt que les méthodes les plus adaptées. Il y a également un autre non-dit : plus les études utilisent les mêmes méthodes, plus il est facile des les comparer avec des méta-analyses, aussi critiquable que soit cette technique qui broie les spécificités des études sur l’autel des moyennes. Bref pas étonnant que tout pousse à utiliser les mêmes méthodes, peu importe si elles sont les plus adaptées ou non…
Dans ce cas-ci, au final, c’est un peu ce que j’ai fait : après quelques recherches, la méthode d’analyse la plus adaptée pour mes données était le tau-c de Stuart-Kendall. On s’en fiche, mais ce qui est intéressant, est que cette méthode n’est pas prévue en standard dans beaucoup de logiciels : c’est dire si elle est spéficique. Donc pour éviter les accusations de p-hacking et donc d’avoir été chercher une méthode tordue et inconnue pour arriver à avoir des résultats, j’ai également inclus d’autres méthodes comme le fameux χ2, qui est la méthode la plus utilisée dans les études de comportement canin, et deux autres méthodes intermédiaires, plus précises mais aussi moins utilisées. Je ne rentre pas dans les détails, mais je trouvais intéressant de saisir ce point pour développer un aspect intéressant de Philosophie des Sciences relatif aux méthodes statistiques.
Bref, au final, quelques corrélations significatives sont apparues:
Q2. Certains chiens réagissent très fortement (aboiements, etc) lorsqu’ils sont surpris, ne réalisant qu’après coup que ce qui les a surpris était en réalité inoffensif ou bien connu d’eux, tandis que d’autres chiens lèvent à peine une oreille et réfléchissent avant de décider si cela vaut la peine de réagir. Sur une échelle de 1 à 7, où 1 correspond à “même surpris, observe avant d’agir” et 7 à “quand il est surpris, réagit immédiatement de façon indiscriminée“, comment définiriez-vous le comportement de votre chien ?
Q3. Certains chiens ont tendance à sursauter très facilement, par exemple lorsqu’ils voient ou entendent quelque chose de soudain ou d’inhabituel. Sur une échelle de 1 à 7, où 1 correspond à un “sursaute rarement / est difficilement surpris” et 7 à une “se surprend facilement / réagit de manière excessive lorsqu’il est surpris”, comment définiriez-vous le comportement de votre chien ?
Sur ces deux questions, le test du χ2, c’est-à-dire le test le plus global, indique une corrélation significative entre les chiens affectés par la mutation est les chiens non-affectés.
De manière intéressante, lorsqu’on utilise les méthodes plus fines (le tau-c et Kruskall-Wallis), une corrélation significative apparait sur une autre question:
Q15. Certains chiens semblent ne pouvoir se relaxer que dans des environnements extrêmement calmes. Ils sont particulièrement perceptifs, et même des stimuli visuels ou auditifs de faible intensité comme de la musique, la TV, ou le chat qui court dans la pièce, les dérangent. Sur une échelle de 1 à 7, où 1 correspond à “il peut dormir dans n’importe quel environnement, peu importe le bruit ou les distractions visuelles” et 7 à “il a besoin du silence total dans la pièce pour arriver à se relaxer complètement”, comment évaluez-vous le comportement de votre chien ?
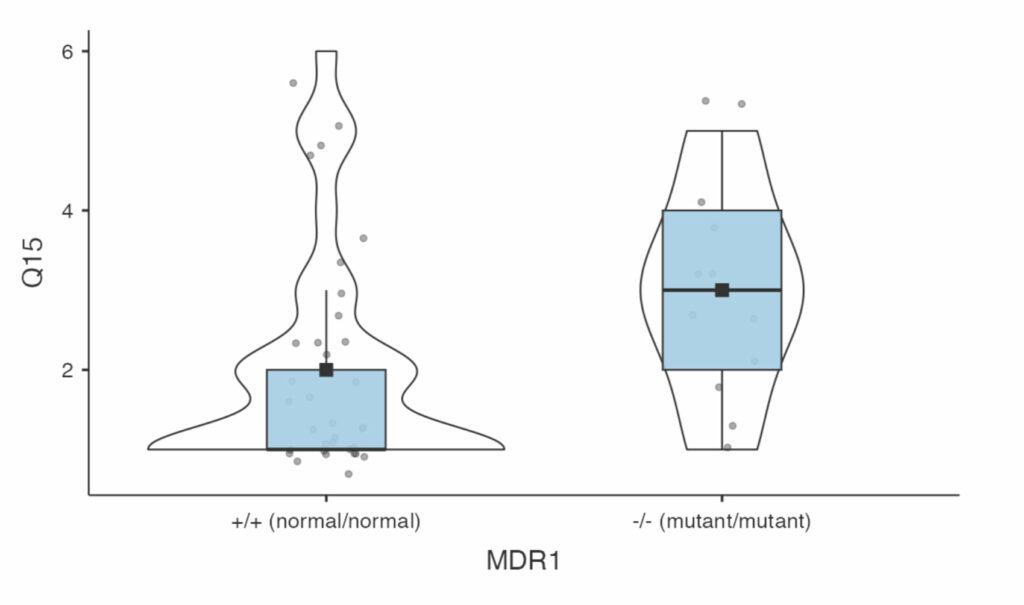
A ce stade, il faut noter que dans ces premières analyses, j’ai été beaucoup plus large que les auteurs des études sur les souris: eux n’ont inclus que les cas extrêmes (les souris complètement indemnes et les souris qui portent deux copies de la mutation, en excluant les souris qui portent un gène normal et un gène mutant), alors que moi j’avais inclus les chiens “+/-”, car ils sont certainement affectés dans dans une moindre mesure.
Par souci de comparaison, j’ai ensuite utilisé les mêmes critères qu’eux, donc j’ai exclu les chiens “+/-” pour ne garder que les cas extrêmes. Et là, sans surprise, Q3 et Q15 montrent une corrélation significative entre score sur cette question et statut MDR1.
Q11. Certains chiens ont une tendance marquée à éviter les personnes ou les situations inconnues ou non familières, par exemple ils ont tendance à quitter la pièce lorsque des invités inconnus arrivent ou lorsque des personnes crient ou qu’il y a des bruits forts. Sur une échelle de 1 à 7, où 1 correspond à “aucune tendance à se cacher ou à éviter les gens ou les situations” et 7 à “forte tendance à se cacher ou à éviter les gens ou les situations”, comment évaluez-vous le comportement de votre chien ?
A noter qu’une autre question arrive tout juste sous le seuil de significativité de p < 0,05 :
Q9. En pensant au tempérament de votre chien, comment définiriez-vous son niveau de nervosité/agitation sur une échelle de 1 à 7 où 1 correspond à “très calme” et 7 à “très nerveux et agité” ?
Je vous passe ici plein de détails sur lesquels je veux bien discuter ailleurs, avec plaisir, mais ça ne vaut pas la peine de rallonger l’article pour tout le monde avec ça…
D’accord, mais qu’est-ce qu’on fait avec ça ?
Globalement, il faudrait plus d’études sur le sujet pour voir si ces résultats se confirment ou non, il faudrait aussi faire la même étude pour d’autres races comme par exemple le Berger Australien, mais ces résultats permettent en tout cas de supposer qu’au-delà de tous les autres facteurs individuels, l’altération de l’axe du stress causée par la mutation MDR1 pourrait effectivement bien avoir un impact sur le caractère de nos chiens, les rendant plus susceptibles d’être particulièrement sensibles aux stimuli inattendus, plus vulnérables à l’anxiété et aux stimulations sensorielles, qu’ils auraient besoin de plus de calme et de silence pour arriver à réellement récupérer, et qu’ils seraient plus méfiants vis-à-vis de la nouveauté.
Fondamentalement, être attentifs à la qualité de l’environnement de repos de nos chiens (voir le Sanctuaire), être vigilants à leur résilience et à leur capacité à appréhender la nouveauté (voir la Ritournelle), et à leur capacité à gérer les contrastes environnementaux, ce sont des conseils de prudence qui sont bénéfiques pour tous les chiens. Mais il est possible que les chiens porteurs du gène MDR1 aient des prédispositions à être particulièrement sensibles sur ces points, et qu’il serait intéressant d’être encore plus attentifs à cela avec eux… Mais comme le dit la formule : “further research is needed” !

